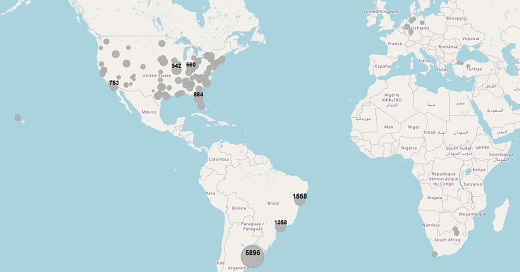
Η δοκιμή των Pfizer/BioNTech C4591001 - Έκθεση ελέγχου - v1 (31-05-2024)
Επανανάλυση των δεδομένων και ανωμαλίες που καταγράφηκαν - Μέρος 1ο
*των OPENVAET, DR AH KAHN SYED, JOSH GUETZKOW, MODARN_LIFE, JKUNADHASAN και BROOK JACKSON*
Keep reading with a 7-day free trial
Subscribe to Critical Thinking to keep reading this post and get 7 days of free access to the full post archives.